Sisu
- Elektronide arv valentskoores
- Samm 1
- 2. samm
- 3. samm
- 4. samm
- Lewise struktuur
- Samm 1
- 2. samm
- 3. samm
- Iga aatomi ametlik laeng
- Samm 1
- 2. samm
- 3. samm
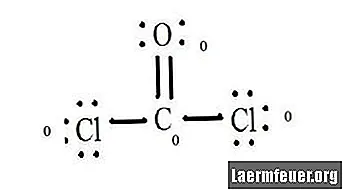
Sellise molekuli nagu CoCl2 (fosgeenigaas) ametliku laengu määramisel on vaja teada iga aatomi valentskihis olevate elektronide arvu ja molekuli Lewise struktuuri.
Elektronide arv valentskoores
Samm 1
Valentskesta elektronide arvu määramiseks otsige elementide perioodilisustabelist iga aatomit.
2. samm
Pidage meeles, et kaks elektroni on esimesel alatasandil s, kaks teisel alatasandil s, kuus elektroni esimesel alatasandil p jne. Pidage meeles: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
3. samm
Löö koormust. Kui molekul on ioon, lisage või lahutage kogusummast üks või mitu elektroni, et jõuda lõpliku laenguni.
4. samm
CoCl2 (gaasiline fosgeen): C = 4; O = 6; Cl = 7. Molekul ei ole ioniseeritud ja sellel on neutraalne laeng. Seetõttu on valentskoores olevate elektronide koguarv 4 + 6 + (7x2) = 24.
Lewise struktuur
Samm 1
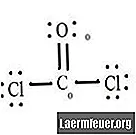
Vaadake CoCl2 (fosgeenigaas) Lewise struktuuri diagrammi. Lewise struktuur tähistab molekuli kõige stabiilsemat ja tõenäolisemat struktuuri. Aatomid tõmmatakse paari valentselektronidega; vabade elektronide vahel moodustuvad oktetireegli rahuldamiseks sidemed.
2. samm

Joonistage iga aatom ja selle valentselektronid ning seejärel moodustage vajadusel sidemed.
3. samm
Kloriidi aatomitel on süsiniku molekuliga lihtsad sidemed, hapniku aatomil aga süsinikuga kaksikside. Iga lõpliku struktuuri aatom rahuldab oktetireeglit ja valentskoores on kaheksa elektroni, mis võimaldab molekulaarset stabiilsust.
Iga aatomi ametlik laeng
Samm 1
Loendage Lewise struktuuris iga aatomi elektronivabad paarid. Igale aatomile määratakse elektron igast sidemest, milles ta osaleb. Lisage need numbrid. CoCl2-s: C = 0 vaba paari pluss 4 sidemete elektroni = 4 elektroni. O = 4 vabapaari elektroni pluss 2 sidemete elektroni = 6 elektroni. Cl = 6 vabapaari elektroni pluss üks sideme elektron C = 7 elektroniga.
2. samm
Lahutage seondumata aatomi valentskoores olevate elektronide arv. Tulemuseks on iga aatomi ametlik laeng. CoCl2 korral: C = 4 valentselektroni (ev) seondumata aatomis miinus 4 Lewise struktuuris tähistatud elektroni (LS) = 0 ametlik laeng O = 6 ev - 6 LS = 0 ametlik laeng Cl = 7 ev - 7 LS = 0 ametlikku lasti
3. samm
Kirjutades asetage need laengud Lewise struktuuri aatomite lähedale. Kui molekulil on kokku laeng, asetage Lewise struktuur sulgudesse, mille ülemisse paremasse nurka on väljastpoolt kirjutatud laeng.