Sisu
Ühendite arv sõltub ühendi struktuurist ja selles sisalduvate elementide oksüdatsiooninumbritest. Elemendi oksüdatsiooninumber on elektronide arv, mida aatomil on või vajab selle tuuma prootonite arvu suhtes. See määrab aatomi laengu, mis on oluline, et kirjeldada teiste aatomitega moodustunud ioonseid ühendeid
Juhised
-
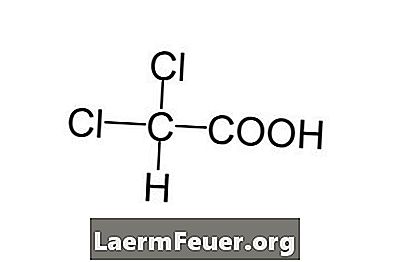
Kirjutage kõnealuse ühendi keemiline valem.
-
Tuvastage ühendis sisalduvad polüatomilised ioonid. Polüatomilised ioonid on ioonsed molekulid, mis koosnevad rohkem kui ühest aatomist (tavaliselt rohkem kui üks element). Vaadake ühiste polüatomiliste ioonide nimekirja ja nende tasude viiteid.
-
Eraldage katioonid ja anioonid. Katioonid on positiivselt laetud ioonid, anioonid on negatiivselt laetud ioonid. Näiteks sisaldab FeSO (4) (raud (II) sulfaat) raua katiooni (Fe + 2) ja anioonsulfaati (SO (4) -2). Oluline on märkida, et sulfaat on polüatomaatiline ioon ja mitte viie erineva iooni komplekt. Rooma number "II" näitab raua +2 oksüdatsiooni numbrit. See võimaldab siduda ainult ühe sulfaataniooniga.
Kui keemilisel sümbolil on sellega seotud eksponent, on selle elemendi aatomid mitmed aatomid. Kui nad ei ole osa polüatomilisest ioonist, siis iga selle elemendi aatom on üksikioon. Näiteks on raud (III) sulfaat kirjutatud kui Fe2 (SO4) 3. Raua +3 oksüdatsiooninumber vajab erinevat arvu sulfaatide arvu ioonse sidumise kohta. Sel juhul seonduvad kaks raud (III) iooni kolme sulfaatiooniga.
-
Lisage katioonide ja anioonide koguarv. Näiteks raud (II) sulfaadil on kaks iooni: raua katioon ja sulfaatanioon.
Kuidas
- Oksüdeerimisnumbrite põhjalik mõistmine aitab kiiresti ja enesekindlalt ühendi ioonilist olemust dešifreerida.
Mida sa vajad
- Perioodiline tabel