Sisu
Molekuli, nagu CoCl2 (fosgeenigaas), ametliku laengu määramisel on vaja teada elektronide arvu iga aatomi valentsikihis ja molekuli Lewise struktuuris.
Juhised

-
Leidke elementide perioodilises tabelis iga aatom, et määrata elektronide arv valentsikihis.
-
Tuletame meelde, et kaks elektroni on esimeses alatasandis s, kaks on teises alatasandis s, kuus elektrooni esimeses alatasandis p jne. Tagasivõtmine: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Löö koormust. Kui molekul on ioon, lisage või lahutage üks või mitu elektroni lõpptarbimise saavutamiseks.
-
CoCl2 (fosgeenigaas) puhul: C = 4; O = 6; Cl = 7. Molekul ei ole ioniseeritud ja omab neutraalset laengut. Seetõttu on elektronide arv valentsikihis 4 + 6 + (7x2) = 24.
Elektronide arv valentsikihis
-
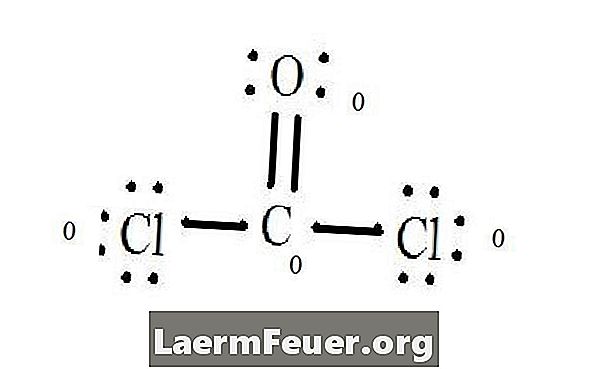
Vaadake CoCl2 (fosgeengaas) Lewise struktuuri diagrammi. Lewise struktuur kujutab endast molekuli kõige stabiilsemat ja tõenäolist struktuuri. Aatomid on joonistatud paari valentselektroniga; vabade elektronide vahel moodustuvad sidemed, et rahuldada okteti reeglit.
-
Joonistage iga aatom ja selle valentselektronid ning seejärel vajadusel vormige sidemeid.
Lewise struktuurile tõmmatud elektronid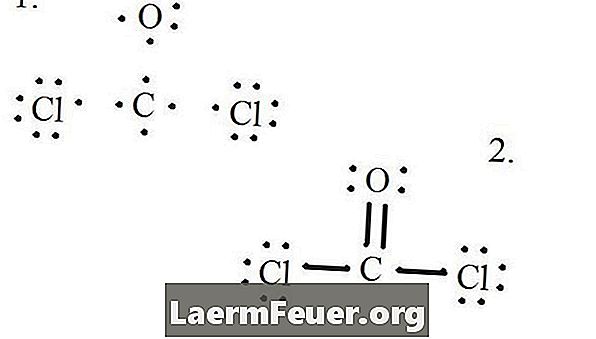
-
Kloori aatomid jagavad süsinikmolekuliga ühekordseid sidemeid, samas kui hapnikuaatom moodustab süsinikuga kaksiksideme. Iga lõppstruktuuri aatom vastab okteti reeglile ja omab valentsikihis kaheksa elektroni, mis võimaldab molekulaarset stabiilsust.
Lewise struktuur
-
Loendage iga aatomi vabade elektronide paar Lewise struktuuris. Iga aatom tähistab iga sideme elektroni, millest ta osaleb. Lisage need numbrid. CoCl2-s: C = 0 vaba paari pluss 4 sidemeelektroni = 4 elektroni. O = 4 vabade paaride elektroni ja 2 elektronide elektronid = 6 elektroni. Cl = 6 elektroni vaba paari pluss üks elektron ühe sideme C = 7 elektroniga.
-
Lahutage sidumata aatomi valentsikihis olevate elektronide arv. Tulemuseks on iga aatomi ametlik tasu. CoCl2-s: C = 4 valentselektrooni (ev) sidumata aatomi miinus 4 elektroni, mis on määratud Lewise struktuuris (LS) = 0 formaalset laengut O = 6 ev - 6 LS = 0 formaalset laengut Cl = 7 ja - 7 LS = 0 ametlikku tasu
Aatomite ametlikud tasud
-
Kirjutades asetage need tasud Lewise struktuuri aatomite lähedusse. Kui kogu molekulil on laeng, asetage Lewise struktuur sulgudes, mis on kirjutatud väljastpoolt paremas nurgas.
Iga aatomi ametlik laeng
Teade
- Üleminekumetalle sisaldavate molekulide ametliku laengu arvutamine võib olla petlik. Üleminekumetallide valentsikihis olevate elektronide arv on need, mis jäävad väärisgaasist välja.
Mida sa vajad
- Elementide perioodiline tabel