Sisu
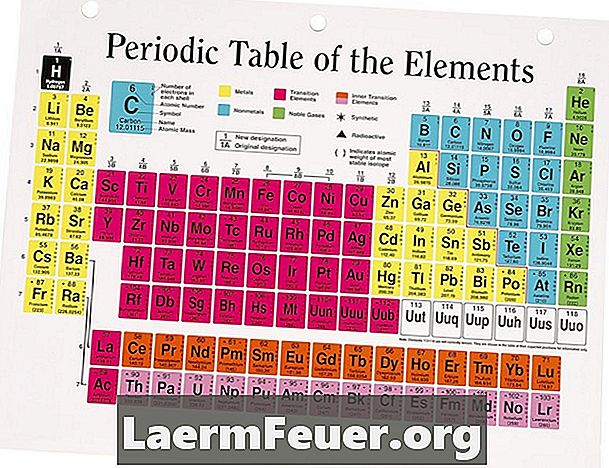
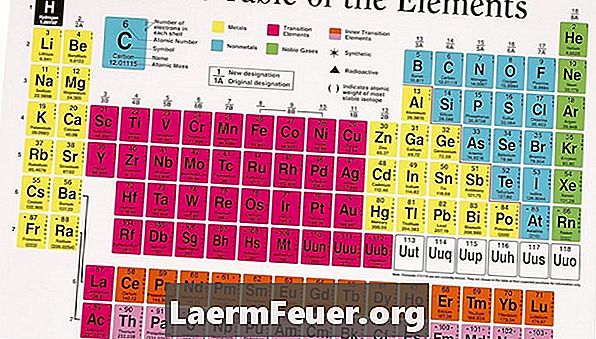
Kuigi elementidel ei ole elektrilaengut, võib nende ioonidel olla positiivne või negatiivne laeng. Seda seetõttu, et neil on sama palju elektrone ja prootoneid, kompenseerides seega kahe osakese poolt tekitatud laenguid. Siiski, kui element ioniseerib, siis ta saab või kaotab elektronid. Perioodiline tabel korraldas need elemendid nii, et on väga lihtne näha, kas ühe neist ioonil on positiivne või negatiivne laeng.
Juhised
-
Mõista, miks mõned elemendid kaotavad elektronid ja teised saavad neid ioniseerimisel. Need on stabiilsemad, kui äärmine kiht säilitab võimalikult palju elektrone. Kui elemendil on lihtsam kaotada elektronid, et saada täielik välimine kiht, teeb see seda ioniseerimisel. Vastupidine juhtub siis, kui elemendil on lihtsam saada välise kihi täitmiseks elektrone.
-
Vaata perioodilist tabelit. Enamikul rühmade (veerud) 1, 2, 3 ja 14 elementidest on ioniseerimisel positiivne laeng. Seda seetõttu, et nad peavad kaotama vähem elektrone, kui nad vajavad täieliku (välise) valentsikihi saamiseks. Seetõttu on neil lihtsam kaotada elektronid, millel on negatiivne laeng. Kuna on rohkem positiivseid laenguid omavaid prootoneid kui elektronid, on neil ioonidel positiivne laeng. Utahi Dixie osariigi kolledži andmetel kannab üleminekuaineid grupp 3 kuni 12 elementi alati positiivset laengut.
-
Leidke negatiivselt laetud ioonid, vaadates perioodilise tabeli gruppe 15, 16 ja 17. t Enamik neist elementidest ioniseerub negatiivse laenguga, sest nad peavad saama vähem elektrone, kui nad kaotavad, et saada täielik valentsikiht. Kuna need elemendid saavad elektronid, on nende ioonidel rohkem elektrone kui prootoneid, andes neile negatiivse laengu.
-
Ettevaatust erinevate elementide suhtes, mis on eelnevalt mainitud nõuannete suhtes erand. Mõned elemendid, nagu süsinik, ei moodusta ioone üksi. Seetõttu ei ole neil ioonidel laengut. Vaadake võrdlusallikaid ja õpikuid põhjaliku ioonikaardi jaoks, et näha, kas otsitav element on erand.
Mida sa vajad
- Elementide perioodiline tabel