![Wounded Birds - Episode 17 - [Multi Lang. Subtitles] Turkish Drama | Yaralı Kuşlar 2019](https://i.ytimg.com/vi/1lN_21HpQG0/hqdefault.jpg)
Sisu
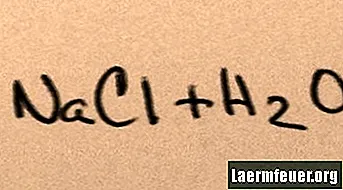
Soola lisamisel veele lahustub see oma komponentmolekulides, kuni vesiniku ja hapniku molekulide ümber hõljuvad maksimaalsed soolaioonid, mida vesi suudab toetada. Kui see juhtub, nimetatakse lahust "küllastunud". Kui rohkem soola on lahustunud, põrkuvad naatriumi ja kloriidi ioonid omavahel kokku ja rekombineeruvad soolakristallides. Seda nähtust nimetatakse "sadestuseks", kuna moodustunud tahke aine langeb vee põhja. Soolad on "hüdrofiilsed", see tähendab, et neid tõmbab vesi. See atraktsioon hõlbustab tuttavat sademete vormi: vihma tilgad tekivad pilvedes pisikeste soolakristallide ümber, muutes selle kergelt soolaseks.
Põhiline

Elektrolüüdid

Sool ei juhi elektrit tahkes olekus, kuid vedelas (vedelas) olekus moodustab see lahenduse, mis suudab elektrit juhtida väga hästi. Juhtivus sõltub kasutatava soola tüübist, kuid need vedelikud, mida nimetatakse elektrolüütide lahusteks, on suurepärased inimkehale vajalike ühendite kandjad. Aju tekitatud elektrilised impulsid toodavad vaba hapnikku, mida veri kasutab. Soolamolekulid klassifitseeritakse lahuses elektrolüütideks (naatrium, kaalium või kaltsium) ja kloriidideks: vere ja neerude kaudu pumbatakse kloriid uriini ja elektrolüüdid jaotuvad neuromuskulaarse süsteemi kaudu protsessis, mida sportlased kutsuvad rehüdratsioon.
Kollektiivsed omadused

Mis tahes lahus erineb selle algsest koostisest, kuna molekulide lisamine muudab vedeliku molekulmassi ja mõjutab ka selle omadusi, isegi kui need ei moodusta uusi ühendeid. Soolavesi on tihedam kui puhas vesi ja külmub ka aeglasemalt. Külmudes migreerub sool aga vedeliku piiridesse, muutes selle raskemaks ja küllastatumaks ning langetades seejärel külmumispunkti. Mateeria seisundi teises otsas, mida tihedam on soolane vesi, seda rohkem on vaja aurustumiseks soojust, kuni vesi otsa saab, jättes soolakihi. Kokad ootavad soola lisamiseks potis oleva vee keemist, et mitte kuumutamist edasi lükata. Need omadused, mida nimetatakse "kolligatiivseteks omadusteks", aitavad teadlastel määrata soolase vee molekulmassi. Kui vedeliku massi, atmosfäärirõhku ja keemistemperatuuri saab mõõta, saavad teadlased lahutada vee molekulmassist, et teada saada, millised soolad on olemas.